Gás Perfeito ou Ideal, Dúvida Fatal!
João Cardoso Pereira Netto |
||
|
Não há uma opinião uniforme e coerente entre os pesquisadores e autores de Química Geral, Físico-Química e Física, quanto aos termos "gás ideal" e "gás perfeito" [1-29]. Alguns identificam essas duas denominações [1,3,8,9,12,29], outros procuram estabelecer uma ligeira diferenciação [1,2,7], e há aqueles que simplesmente adotam uma delas, sem tomar conhecimento da outra, como se ela não existisse [4-7,10,11, 13-29]. Outro aspecto que pode ser considerado como mais um elemento complicador na análise das definições desses termos é que algumas delas não possuem, do ponto de vista físico, uma estrutura coerente [1,8]. Finalmente, encontramos mais um elemento que contribui para aumentar a confusão existente nessas definições, quando conseqüências da Termodinâmica e da Teoria Cinética dos Gases são chamadas para auxiliá-las ou justificá-las [1,3,5,7,9,12]. Em alguns casos semelhantes há uma certa preocupação em apresentar a definição dos termos envolvidos com alguma coerência. Isto pode ser observado, por exemplo, quando conceitos bem estabelecidos são alterados para esse fim, como é o caso do conceito de ponto material - uma entidade abstrata e sem dimensão -, para se fazer uma distinção entre ponto matemático e ponto material físico [5], cuja finalidade é atribuir uma dimensão desprezível ao ponto. O objetivo é óbvio, uma vez que partículas pontuais não tem dimensão, e portanto, não podem colidir. Não é difícil perceber a confusão, decorrente da falta de uma definição clara e concisa, existente nas formulações encontradas nesses livros e artigos; há confusão tanto no tratamento macroscópico quanto no microscópio. Com base na análise das definições e afirmações encontradas, as seguintes alternativas foram usadas para definir gás ideal e/ou gás perfeito:
De fato, os termos "ideal" e "perfeito" não têm o mesmo significado, o que se pode observar já nas suas próprias definições:
Nas Ciências Exatas, a situação se complica ainda mais, uma vez que esses termos podem ter outros significados. Assim, com relação ao termo "ideal", ele pode ser interpretado como a aspiração máxima de representação físico-matemática de um modelo, entendendo, neste caso, como aquele que leva em consideração todas as variáveis que podem atuar em um determinado fenômeno e cujo desenvolvimento conduz a equações que reproduzem exatamente aquele fenômeno. Contudo, o termo "ideal" também pode estar associado à representação físico-matemática ou conceitual mais simplista do mesmo fenômeno (Cfr. Salvagnini in ReGEQ 1). Isto é, ele pode corresponder a uma situação em que expressões mais simples são obtidas, envolvendo ou não um menor número de variáveis. Nestas condições, ocorre em geral, a imposição de uma ou mais condições a uma ou mais variáveis microscópicas ou macroscópicas, a partir das quais se obtém aquela representação fenomenológica extrema (limite). Como existem diferenças nessas definições, somos levados a concluir que deve haver uma distinção também entre as denominações "gás ideal" e "gás perfeito". Esta distinção para nós é pertinente, uma vez que, tomando o vapor d’água a 10 mmHg e 20C como exemplo, podemos dizer que ele tem comportamento ideal, mas não é gás perfeito, já que nestas condições pode ser condensado. Acreditamos que uma das dificuldades inerentes a esta questão esteja em se estabelecer, com critério, a diferença conceitual entre o símbolos: = 0 e 0 Quando escrevemos igual a zero (= 0), estamos nos referindo a uma igualdade, a uma relação precisa, a uma afirmação, real ou não, a partir da qual queremos obter ou construir, sem aproximações, sem falhas, alguma coisa como por exemplo, uma teoria. A Teoria Cinética dos Gases Perfeitos (T.C.G.P.) estabelece em seus postulados dois vínculos extremos, em termos de igualdade, respectivamente, para o volume próprio das moléculas gasosas, e para as forças de interação entre as moléculas, representados por: vi = 0 e fi = 0 a partir dos quais, juntamente com as leis do movimento de Newton aplicadas às partículas, e da definição de pressão, se obtém, de forma rigorosa, a equação:
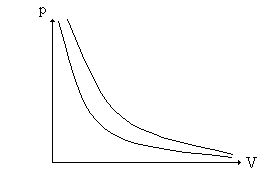
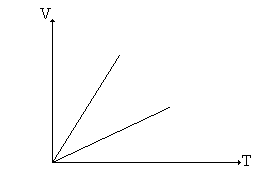
sem a necessidade de haver qualquer menção acerca do comportamento da pressão ou da temperatura para a sua obtenção. Conseqüentemente, de acordo com a T.C.G.P., ela deve ser válida para todo o intervalo dessas variáveis. Como resultado, quando representamos, graficamente, as leis de Boyle (T = cte) e de Gay-Lussac (P = cte), conforme os gráficos abaixo:
estamos nos referindo a essas leis como "Leis dos Gases Perfeitos" [3c]; caso contrário, como veremos mais adiante, não teria sentido representar, por exemplo, o eixo das pressões ou das temperaturas. Conseqüentemente, as representações bidimensionais e tridimensionais das isotermas, isócoras e isóbaras encontradas na maioria dos livros e artigos científicos [3b, 18c], são representações de "gás perfeito" e não de gás ideal". O símbolo tender a zero ( 0) impõe uma condição, um vínculo para a validade do resultado que se vai obter após a sua utilização (a igualdade não necessita dessa lembrança). Não se trata de uma igualdade, mas de uma condição limite, em geral relacionada com uma impossibilidade prática, se ela fosse substituída pela igualdade (P = 0 em vez de P 0). Na igualdade, os resultados dependem rigidamente da relação assumida; na condição tender a ( ), por outro lado, a concordância com os resultados experimentais vai se tornando cada vez melhor à medida que nos aproximamos da condição imposta. Assim, ao escrevermos x = 0, estamos afirmando que só interessa o resultado obtido a partir dessa condição, enquanto que expressões do tipo X 0 (ou X ) significam que a relação obtida é tanto mais correta quanto mais nos aproximamos da condição imposta, isto é, em X 0. Assim, neste caso não tem sentido utilizar X como um dos eixos coordenados, a não ser na validade do vínculo. O presente trabalho tem dois objetivos fundamentais: apresentar as definições de gás real, perfeito e ideal, de modo que haja coerência e uniformidade entre elas e encontrar um elo entre as três definições, de modo que o estudo dos gases seja mais consistente.
A) Gás Real É todo gás que existe, em qualquer condição de pressão e temperatura. É constituído de pequenas partículas materiais de massa mi, e dotadas de movimento caótico. Estas partículas estão sujeitas a forças de atração em longas distâncias e a forças de repulsão quando em curtas distâncias. A idéia de que elas têm massa é antiga e remonta aos tempos dos filósofos gregos: se elas não tivessem massa, não sentiríamos o ar bater em nossas faces. Por outro lado, as forças de interação são necessárias para explicar, por exemplo, o fenômeno da condensação. A existência e importância das forças de interação sugere a necessidade do conhecimento do potencial de interação entre partículas, para o conhecimento real do comportamento dos gases. É a falta de compreensão correta desses potenciais de interação entre partículas - mesmo empregando técnicas da Mecânica Estatística ou da Mecânica Quântica - que tornam este assunto um dos poucos sem resolução, desde o início da sua interpretação no século passado. Concluindo, podemos dizer que o gás real é um gás cujas partículas têm massa mi>0, volume vi >0 e forças de interação fi 0.
B) Gás Perfeito É um gás hipotético, que não existe; é um modelo físico-matemático de umas das teorias mais bem construídas pela mente humana: a Teoria Cinética dos Gases. Um dos sucessos dessa teoria foi explicar, de forma convincente, as leis empíricas dos gases, a lei de Graham e outros resultados importantes como, por exemplo, a eqüipartição da energia total de um sistema. As duas maneiras mais simples de apresentar essa teoria são: 1) Teoria Cinética dos Gases Perfeitos e 2) Teoria Cinética dos Gases como Esferas Rígidas.
Teoria Cinética dos Gases Perfeitos Seus postulados são os seguintes:
A partir desses postulados, podemos tirar as seguintes conclusões:
Com esse modelo, a Teoria Cinética dos Gases fornece como um de seus resultados mais expressivos, a equação [3d]:
que, com a seguinte relação:
reproduz a famosa equação de Clapeyron:
estabelecendo um vínculo entre teoria e resultados experimentais. |
||
Referências Bibliográficas 1) Levine, I.N., Physical Chemistry, McGraw-Hill Kogakusha, I. S. ed, Tokyo, 1978. 2) Moore, W. J., Físico-Química, vol. 1 trad. 4a ed, Editora Edgard Blucher Ltda, 1976. 3) Atkins, P. W., Physical Chemistry, Oxford University Press, Oxford, Fifth ed. 1944 4) Fried, V., Hameka, H. F., Blukis, U., Physical Chemistry, Mcmillan Publishing Co., Inc.; N. Y.. 1975. 5) Bauman, R. P., Moren Thermodynamics with Statistical Mechanics. Macmillan Publishing Co., N. Y., 1972. 6) Brescia, F. Arents, J. Meislich, H. & Truk General Chemistry, John Wiley & Sons, N. Y., 1976. 7) Eggers Jr, N. W., Halsey Jr, G. D. & Rabinovitch, B. S., Físico-Química, Editorial Limusa-Wiley S. A ., México, 1967. 8) Berry, R. S., Rice, S. A . Ross, J., Physical Chemistry, John Wiley & Sons, N. Y., 1976. 9) Pitzer, K. S., Brewer, L., Thermodinamics, second ed., McGraw-Hill Book CoTokyo, 1961. 10) Daubert, T.E., Chemical Engineering Thermodynamics McGraw-Hill Book Co., Int. Ed., Singapore, 1985. 11) Abott, M.M. e Van Ness, H. C., Termodinâmica, McGraw-Hill, Portugal 1992. 12) Glasstonne, S., Tratado de Química Física, Aguilar Ed., Madrid, 1976 13) Sears, F., Zemansky, M. W. & Young, H. D., Física, v. 2, 2a Ed., Livros Técnicos e Científicos Editora, R.J., 1984. 14) McKelvey, J,P. & Groth, H., Física, vol.2, Harper & Row do Brasil, S.P., 1978. 15) Tripler, P. A., Física para Cientistas e Engenheiros, vol.2, terceira ed., Ed. Guanabara Koogan S. A ., R. J., 1994. 16) Kauzmann, W., Teoria Cinética de los Gases, Editorial Reverté, S. A ., Barcelona, 1970. 17) Pilla, I., Físico-Química, vol. 1, Livros Técnicos e Científicos S. A ., 1979. 18) Alberty, R. A., Sibey, R. J., Physical Chemistry, John Wiley & Sons Inc., Singapore, 1992. 19) Maron, S. H. & Prutton, C. F., Fundamentos de Físico Química, Editorial Limusa, México, 1980. 20) Mahan, B. & Myers, R. J., Química - Um Curso Universitário, trad. 4a. ed., Editora Edgard Blucher Ltda, S.P., 1995. 21) Brady, J. e . & Humiston, G. E., Química Geral, vol. 1, 2a ed., Livros Técnicos e Científicos Editora S. A ., 1986. 22) Russell, J. B. Química Geral, vol. 1, 2a ed. Makron Books Editora Ltda, S.P., 1994. 23) Catellan, G., Fundamentos de Físico-Química, Livros Técnicos e Científicos Editora, R. J., 1995. 24) Lask, A . M., J. Chem. Educ., 51, 141 (1974). 25) Cagle Jr, F. W., Chem. Educ.,692 (1973). 26) Deal, W. J., Chem. Educ., 405-407 (1975). 27) Herron, J. D., Chem. Educ., 530-531. 28) Levine, S., Chem. Educ.,399 (1985). 29) Pilar, F. L., Chem. Educ.,284-285 (1967). |