Teoria Cinética dos Gases como Esferas Rígidas Seus postulados são os seguintes:
A partir destes postulados, podemos tirar as seguintes conclusões:
e não a equação de Clapeyron.
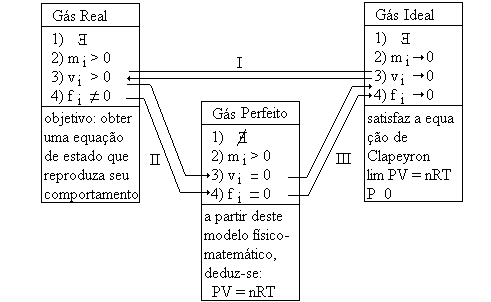
C) Gás Ideal Comparando as considerações apresentadas anteriormente para os gases reais e perfeito, deparamo-nos com o seguinte problema: temos um gás real cujas propriedades P, V e T, podem ser determinadas experimentalmente e para o qual queremos obter uma equação chamada de "Equação de Estado", que apresente boa concordância quando comparada com valores experimentais. Em contrapartida, temos uma equação teórica, válida para um gás que não existe! Além disso, temos equações empíricas, obtidas de resultados experimentais sobre o comportamento dos gases reais, em condições particulares, que concordam com as conclusões da Teoria Cinética dos Gases Perfeitos. O gás ideal desempenha o elo entre o gás real e o gás perfeito, com o objetivo de dar coerência à situação apresentada anteriormente. Nestas condições, o gás ideal é um gás real, submetido a determinadas condições, em geral P 0, tais que sejam satisfeitos os seguintes vínculos:
fi 0 Esses vínculos podem ser observados se adotarmos as seguintes condições: P 0 ou T Como é muito mais fácil trabalhar com a condição P 0 (a outra, T , além da dificuldade de operação, fica limitada pela dissociação da partícula), esta é a condição mais empregada para se obter a equação do "gás ideal". Com essas considerações, a equação que representa, rigorosamente, o comportamento de gás ideal é: lim P.V = n.R.T p0 Portanto, um gás ideal é um gás para o qual temos: massa mi > 0, volume vi 0 e forças de interação fi 0. Com essas definições de gás real, perfeito e ideal, e suas interações, é mais fácil compreender e entender a evolução do estudo do gases. No esquema que segue, apresentamos as características mais marcantes de cada definição e do elo entre elas.
I) modelo teórico; II) modelo do gás ideal, a partir das condições do gás perfeito; III) levantando as duas condições limites do gás ideal, deve-se obter a equação para gás real.
Conclusões A partir das definições propostas anteriormente, podemos tirar as seguintes conclusões:
|
Referências Bibliográficas 1) Levine, I.N., Physical Chemistry, McGraw-Hill Kogakusha, I. S. ed, Tokyo, 1978. 2) Moore, W. J., Físico-Química, vol. 1 trad. 4a ed, Editora Edgard Blucher Ltda, 1976. 3) Atkins, P. W., Physical Chemistry, Oxford University Press, Oxford, Fifth ed. 1944 4) Fried, V., Hameka, H. F., Blukis, U., Physical Chemistry, Mcmillan Publishing Co., Inc.; N. Y.. 1975. 5) Bauman, R. P., Moren Thermodynamics with Statistical Mechanics. Macmillan Publishing Co., N. Y., 1972. 6) Brescia, F. Arents, J. Meislich, H. & Truk General Chemistry, John Wiley & Sons, N. Y., 1976. 7) Eggers Jr, N. W., Halsey Jr, G. D. & Rabinovitch, B. S., Físico-Química, Editorial Limusa-Wiley S. A ., México, 1967. 8) Berry, R. S., Rice, S. A . Ross, J., Physical Chemistry, John Wiley & Sons, N. Y., 1976. 9) Pitzer, K. S., Brewer, L., Thermodinamics, second ed., McGraw-Hill Book CoTokyo, 1961. 10) Daubert, T.E., Chemical Engineering Thermodynamics McGraw-Hill Book Co., Int. Ed., Singapore, 1985. 11) Abott, M.M. e Van Ness, H. C., Termodinâmica, McGraw-Hill, Portugal 1992. 12) Glasstonne, S., Tratado de Química Física, Aguilar Ed., Madrid, 1976 13) Sears, F., Zemansky, M. W. & Young, H. D., Física, v. 2, 2a Ed., Livros Técnicos e Científicos Editora, R.J., 1984. 14) McKelvey, J,P. & Groth, H., Física, vol.2, Harper & Row do Brasil, S.P., 1978. 15) Tripler, P. A., Física para Cientistas e Engenheiros, vol.2, terceira ed., Ed. Guanabara Koogan S. A ., R. J., 1994. 16) Kauzmann, W., Teoria Cinética de los Gases, Editorial Reverté, S. A ., Barcelona, 1970. 17) Pilla, I., Físico-Química, vol. 1, Livros Técnicos e Científicos S. A ., 1979. 18) Alberty, R. A., Sibey, R. J., Physical Chemistry, John Wiley & Sons Inc., Singapore, 1992. 19) Maron, S. H. & Prutton, C. F., Fundamentos de Físico Química, Editorial Limusa, México, 1980. 20) Mahan, B. & Myers, R. J., Química - Um Curso Universitário, trad. 4a. ed., Editora Edgard Blucher Ltda, S.P., 1995. 21) Brady, J. e . & Humiston, G. E., Química Geral, vol. 1, 2a ed., Livros Técnicos e Científicos Editora S. A ., 1986. 22) Russell, J. B. Química Geral, vol. 1, 2a ed. Makron Books Editora Ltda, S.P., 1994. 23) Catellan, G., Fundamentos de Físico-Química, Livros Técnicos e Científicos Editora, R. J., 1995. 24) Lask, A . M., J. Chem. Educ., 51, 141 (1974). 25) Cagle Jr, F. W., Chem. Educ.,692 (1973). 26) Deal, W. J., Chem. Educ., 405-407 (1975). 27) Herron, J. D., Chem. Educ., 530-531. 28) Levine, S., Chem. Educ.,399 (1985). 29) Pilar, F. L., Chem. Educ.,284-285 (1967). |