Um Experimento Simples para Observar a Influência da Geometria do Reator no Andamento da Fermentação Alcoólica Descontínua em Reatores não Agitados
Walter Borzani1, Claudia Y. Soyama2,
Fabiana S. de Souza2 e Patrícia M. Furuko2
Escola de Engenharia Mauá. Centro Universitário do Instituto Mauá de Tecnologia.
Praça Mauá, 1, 09580-900, São Caetano do Sul, SP.
INTRODUÇÃO
Em sua quase totalidade, os estudos da influência da geometria do reator no andamento de processos fermentativos foram realizados em processos aeróbios, uma vez que, nestes processos, a geometria do fermentador afeta consideravelmente o fornecimento do oxigênio indispensável à atividade microbiana (Scragg et al., l987; Merchuk & Siegel. 1988; Yahiro et al., 1987; Gravilesdu & Tudose, 1988).
Ocorre, porém, que em importantes processos fermentativos anaeróbios há intensa produção de gases, cujo desprendimento acarreta agitação do meio em fermentação. Essa agitação pode afetar positivamente o andamento do processo, por favorecer a transferência dos nutrientes do meio para as células microbianas. Por outro lado, o estado de agitação do meio é afetado pela geometria do reator, concluindo-se que esta última pode influir no andamento do processo. Exemplos importantes desses processos anaeróbios são a fermentação alcoólica (desprendimento de CO2), a fermentação acetono-butanólica (desprendimento de CO2 e H2) e o tratamento anaeróbio de águas residuárias (desprendimento de CO2 e CH4).
No tratamento anaeróbio de águas residuárias, o trabalho de Sung & Dague (1995) mostrou que reatores com H/D (H = altura do reator D = diâmetro do reator) entre 1,8 e 5,6 apresentam melhor desempenho do que o obtido em reatores com H/D 0,61 a 0,93.
Ensaios preliminares realizados por Valdeolivas Gómez et al. (1981) mostraram que a geometria inadequada do reator pode acarretar aumentos de até 60% no tempo necessário para que a fermentação alcoólica se complete.
Não foram encontradas referências ao tema em apreço no caso da fermentação acetono-butanólica.
O objetivo deste artigo é descrever um experimento relativamente simples para, em cursos de graduação, observar a influência da geometria do reator (não agitado) no andamento da fermentação alcoólica por processodescontinuo.
_______________________
1 Professor da disciplina Engenharia Bioquímica
2 Aluna do Curso de Engenharia de Alimentos.
DESCRIÇÃO DO EXPERIMENTO
1. Preparo do inóculo.
O inóculo é preparado suspendendo-se fermento prensado (Saccharomyces cerevisae) em água destilada. Esta suspensão deve ser agitada por 3 a 5 min para assegurar a desagregação das partículas do fermento. A Tabela 1 indica, a título de sugestão, as quantidades de fermento e de água para o preparo de três inóculos.
Tabela 1. Preparo dos inóculos.
Inoculo Nº
Massa de fermento prensado (g)
Volume de água destilada (L)
1
120
1
2
220
1
3
320
1
2. Preparo do meio concentrado.
A Tabela 2 mostra, também a titulo de sugestão, as composições de três meios concentrados. O pH do meio deve ser ajustado em 4 a 5, por adição de solução de H2S04.
Tabela 2. Preparo dos meios concentrados
Componente do meio
Meio Nº1
Meio Nº2
Meio Nº3
Glicose (g)
400
600
800
KH2PO4(g)
16
24
32
Uréia(g)
7
10
14
Extrato de levedura (g)
7
10
14
MgSO4.7H20 (g)
3
4,5
6
Água destilada (L)
3
3
3
3. Preparo do meio inoculado.
O meio inoculado é preparado adicionando-se 1 L de inóculo a 3 L de meio concentrado. A Tabela 3 mostra os valores aproximados das concentrações iniciais de glicose e de fermento nos nove meios inoculados que podem ser obtidos combinando--se os meios concentrados da Tabela 2 com os inóculos da Tabela 1.
Tabela 3. Concentrações iniciais aproximadas de glicose e de fermento prensado nos meios inoculados.
Meio inoculado Nº
Concentrações Glicose
iniciais (g/L)
Fermento prensado1
100
30
2
100
55
3
100
80
4
150
30
5
150
55
6
150
80
7
200
30
8
200
55
9
200
80
4. Reatores.
Serão apresentados, neste artigo, alguns dos resultados obtidos utilizando-se, como reatores, um cilindro graduado de 1 L, um béquer de 1 L e um frasco de Erlenmeyer de 2 L. Cada reator recebeu 1 L de meio inoculado. A altura da camada de meio inoculado era de, aproximadamente, 37 cm no cilindro, 13 cm no béquer e 6,5 cm no frasco de Erlenmeyer. O cilindro e o béquer foram cobertos com tampas metálicas munidas de gargalos cujos diâmetros eram iguais ao do frasco de Erlenmeyer (ver Figura 1). Os gargalos receberam um chumaço de algodão hidrófobo (massa de cada chumaço 4,4 g).
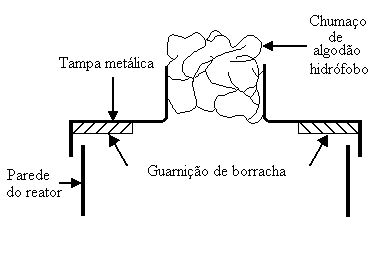
Fig. 1 - Representação esquemática da tampa metálica do reator.
5. Acompanhamento da fermentação.
Uma vez medida a massa inicial do sistema (reator + meio inoculado), o conjunto foi colocado em estufa a 310C. Periodicamente (a cada 30 mim, ou a cada 60 mim, dependendo das concentrações iniciais de glicose e de fermento) media-se a massa do sistema. A diminuição da massa do sistema é conseqüência de: a) desprendimento do CO2 produzido na fermentação; b) evaporação de água e, também, de substâncias relativamente voláteis (etanol e aldeídos) formadas no processo. Decorre desse último fato a necessidade de avaliar a perda de massa do sistema por evaporação.
6. Perda de massa por evaporação.
As velocidades de perdas por evaporação foram determinadas colocando-se, em cada reator, 1 L de água destilada, e medindo-se a diminuição da massa de cada sistema mantido a 310C por 24 h. As mesmas medidas foram efetuadas substituindo-se a água por 1 L de solução aquosa de etanol (concentração aproximada de etanol = 80 g/L, valor este próximo da concentração de etanol ao final da fermentação dos meios inoculados Nos 7, 8 e 9). Foram obtidos os resultados apresentados na Tabela 4.
Tabela 4. Velocidades de evaporação
Reator
Velocidade
(g/h)
Água
Sol. de etanol (~80 g/L)
Erlenmeyer
0,040
0,050
Cilindro
0,070
0,100
Béquer
0,120
0,190
ALGUNS RESULTADOS
As Figuras 2 e 3 mostram as perdas de massa (P) durante as fermentações dos meios inoculados Nos 7 e 3 (ver Tabela 3), respectivamente.
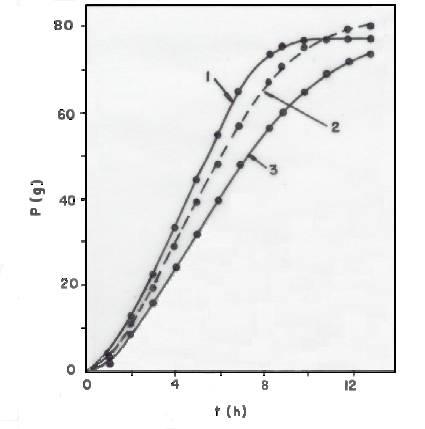
Fig. 2 - Perda de massa (P) dos reatores, em função do tempo (t),
durante a fermentação do meio inoculado nº 7 (ver tabela 3). Curva 1:
cilindro. Curva 2: béquer. Curva 3: frasco Erlenmeyer.
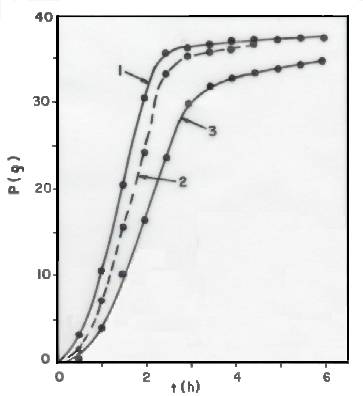
Fig. 3 - Perda de massa (P) dos reatores, em função do tempo (t),
durante a fermentação do meio inoculado nº 3 (ver tabela 3). Curva 1:
cilindro. Curva 2: béquer. Curva 3: frasco Erlenmeyer.
A comparação dos resultados obtidos no cilindro e no frasco de Erlenmeyer, porém, deve levar em conta que as velocidades de evaporação são maiores no cilindro (ver Tabela 4). A maior diferença entre as velocidades de evaporação nestes dois reatores (0,100 - 0,040 = 0.060 g/h) não explica, contudo, as diferenças entre o P no cilindro e o Pno frasco de Erlenmeyer, diferenças estas que alcançam 17,1 g(ver Figura 2; t =8,4 h) e 13,9 g (ver figura 3; t = 2,0 h), apenas para citar dois valores. Também neste caso, portanto, a fermentação foi mais rápida no cilindro.
Considerações análogas poderiam ser feitas na comparação dos resultados obtidos no béquer e no frasco de Erlenmeyer, concluindo-se que a fermentação foi mais rápida no béquer.
Em resumo, os resultados apresentados mostram que a geometria do reator pode afetar significativamente o andamento da fermentação.
REFERÊNCIAS BIBLIOGRÁFICAS
Giavrilescu, M & Tudose, R Z. 1998. Bioprocess Eng, 19, 175- 178
Merchuk, J.C. & Siegel, M.H. 1988. J. Chem. Technol. Biotechnol., 41, 105-120.
Scragg, A. H., Morris, P., Allan, E.J., Bond, P. & Fowler, M. W. 1987. Enzyme Microb. Technol., 9, 619-624.
Sung, S. & Dague, R.R. 1995. Wat. Env. Res., 67, 294-301.
Valdeolivas Gómez, E. I., Vairo, M.L.R. & Borzani, W. 1981. Arq. Biol. Tecnol., 24, 361-366.
Yahiro, K., Takahama, T., Jai, S., Park, Y. & Okabe, M. 1997. Biotechnol. Letters, 19, 619-621.